GRUPOS 4-5-6-7 DE
LA TABLA PERIÓDICA
LAURA KARINA CASTAÑEDA VANEGAS
11-1
QUÍMICA
INSTITUCIÓN EDUCATIVA EXALUMNAS
DE LA PRESENTACIÓN
IBAGUÉ - TOLIMA
2019
INTRODUCCIÓN:
En este trabajo se darán a conocer todos los aspectos relacionados a los grupos A cuatro, cinco, seis y siete de la tabla periódica. Se hablará de cada elemento que hace parte de cada uno de los grupos. Todos sus usos, sus elementos, sus características generales, etc.
OBJETIVOS:
Objetivo general:
Comprender la constitución en general de cada uno de los grupos utilizados en este trabajo de la tabla periódica.
Objetivos específicos:
Analizar la composición y los usos de cada uno de los elementos de la tabla periódica.
Aprender los nombres de los elementos, sus aplicaciones y sus definiciones.
Poner en práctica lo aprendido en el trabajo.
Investigar más a fondo sobre el tema, para tener un aprendizaje completo.
MARCO TEÓRICO:
En este trabajo se hablará de los grupos 4-5-6 y 7 A de la tabla periódica, en general son 20 elementos, 5 por cada grupo. Para ello debemos entender la composición en general de la tabla periódica, en la tabla periódica los elementos están ordenados de forma que aquellos con propiedades químicas semejantes, se encuentren situados cerca uno de otro.
Los elementos se distribuyen en filas horizontales, llamadas períodos. Pero los periodos no son todos iguales, sino que el número de elementos que contienen va cambiando, aumentando al bajar en la tabla periódica.
El periodo que ocupa un elemento coincide con su última capa electrónica. Es decir, un elemento con cinco capas electrónicas, estará en el quinto periodo. El hierro, por ejemplo, pertenece al cuarto periodo, ya que tiene cuatro capas electrónicas.
- Período 1 - 2 elementos:
- Período 3 - 8 elementos:
- Período 4 - 18 elementos:
- Período 6 - 32 elementos:
Las columnas de la tabla reciben el nombre de grupos. Existen dieciocho grupos, numerados desde el número 1 al 18. Los elementos situados en dos filas fuera de la tabla pertenecen al grupo 3.
En un grupo, las propiedades químicas son muy similares, porque todos los elementos del grupo tienen el mismo número de electrones en su última o últimas capas.
Grupo 4 A de la tabla periódica:

Los elementos del grupo IV A son: carbono (C), silicio (si), germanio (ge), estaño (Sn),plomo (Pb), erristeneo (Eo). Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2, p2.
Los elementos de este grupo presenta diferentes estados de oxidación y estos son: +2 y +4., los compuestos orgánicos presentan variedad en su oxidación Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico. Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
En este grupo encontramos variedad en cuanto a sus características físicas y químicas.
1. Carbono (C):
Es un elemento químico de número atómico 6, es un sólido a temperatura ambiente. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.

Características:
El carbono es un elemento que posee formas alotrópicas, un caso fascinante lo encontramos en el grafito y en el diamante, el primero corresponde a uno de las sustancias más blandas y el segundo a uno de los elementos más duros y otro caso con el carbón y el diamante, el carbón es tienen un precio comercial bastante bajo en cambio el diamante es conocido por ser una de las piedras mas costosas del mundo.
Presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples. Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas, con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos.
Estados alotrópicos:
Se conocen cinco formas alotrópicas del carbono, una de las formas como encontramos el carbono es el grafito el grafito tienen exactamente la misma cantidad de átomos que el diamante la única variación que este presenta esta en la estructura la estructura del diamante es tetraédrica y la del grafito es mucho más sencilla. Pero por estar dispuestos en diferente forma, su textura, fuerza y color son diferentes.

Es un metaloide de numero atómico 14 de grupo A4. El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.

En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja.
Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u
Estados del silicio:
El silicio lo podemos encontrar en diversas formas en polvo, policristal ver y olivino.


Aplicaciones:
Se utiliza en aleaciones, en la preparación de las siliconas, en la industria de la cerámica técnica y, debido a que es un material semiconductor muy abundante, tiene un interés especial en la industria electrónica y microelectrónica como material básico para la creación de obleas o chips que se pueden implantar en transistores, pilas solares y una gran variedad de circuitos electrónicos. El silicio es un elemento vital en numerosas industrias.
3. Germanio:
Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño. El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm).
El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales.
.jpg)
Características:
Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.
Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
Aplicaciones:
Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos Fibra óptica. Electrónica: radares y amplificadores de guitarras eléctricas usados por músicos nostálgicos del sonido de la primera época del rock and roll; aleaciones SiGe en circuitos integrados de alta velocidad. También se utilizan compuestos sándwich Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos. Lentes, con alto índice de refracción, de ángulo ancho y para microscopios. En joyería se usa la aleación Au con 12% de germanio.
El estaño se conoce desde antiguo: en Mesopotamia se hacían armas de bronce, Plinio menciona una aleación de estaño y plomo, los romanos recubrían con estaño el interior de recipientes de cobre. Representa el 0,00023% en peso de la corteza. Raramente se encuentra nativo, siendo su principal mineral la casiterita (SnO2).
También tiene importancia la estannita o pirita de estaño. La casiterita se muele y enriquece en SnO2 por flotación, éste se tuesta y se calienta con coque en un horno, con lo que se obtiene el metal. Para purificarlo (sobre todo de hierro) se eliminan las impurezas subiendo un poco por encima de la temperatura de fusión del estaño, con lo que éste sale en forma líquida.
.jpg)
Características:
Es un metal, maleable, que no se oxida y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Una de sus características más llamativas es que bajo determinadas condiciones forma la peste del estaño.
Formas alotrópicas:
El estaño puro tiene dos variantes alotrópicas: El estaño gris, polvo no metálico, conductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco.
Aplicaciones:
Se usa como revestimiento protector del cobre, del hierro y de diversos metales usados en la fabricación de latas de conserva. También se usa para disminuir la fragilidad del vidrio. Los compuestos de estaño se usan para fungicidas, tintes, dentífricos (SnF2) y pigmentos. Se usa para hacer bronce, aleación de estaño y cobre.
Se usa para la soldadura blanda, aleado con plomo. Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales. En etiquetas. Recubrimiento de acero. Se usa como material de aporte en soldadura blanda con cautín, bien puro o aleado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos. El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un o pacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.

Es un elemento de la tabla periódica, cuyo símbolo es Pb y su número atómico es 82 Dmitri Mendeléyev químico no lo reconocía como un elemento metálico común por su gran elasticidad molecular. Cabe destacar que la elasticidad de este elemento depende de las temperaturas del ambiente, las cuales distienden sus átomos, o los extienden. El plomo es un metal de densidad relativa 11,45 a 16 °C tiene una plateada con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, in-elástico y se funde con facilidad. Su fusión se produce a 326,4 °C y hierve a 1745 °C. Las valencias químicas normales son 2 y 4.

Los compuestos de plomo más utilizados en la industria son los óxidos de plomo, el tetraetilo de plomo y los silicatos de plomo. Una de las características del plomo es que forma aleaciones con muchos metales como el calcio estaño y bronce, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones. Es un metal pesado y tóxico, y la intoxicación por plomo se denomina saturnismo o plumbosis.

Aplicaciones:
El plomo se usa como cubierta para cables, ya sea la de teléfono, de televisión, de Internet o de electricidad, sigue siendo una forma de empleo adecuada. La ductilidad única del plomo lo hace particularmente apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductores internos.

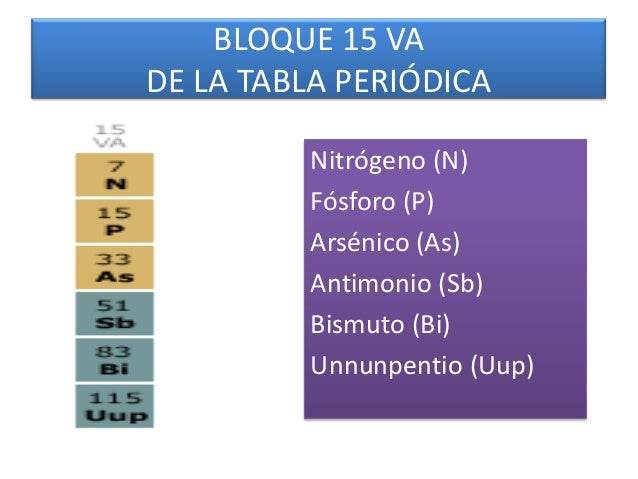
Grupo 5 A de la tabla periódica:
En este grupo el nitrógeno (N) y el fósforo (P) son no metales, el arsénico (As) y antimonio (Sb) son metaloides, y el bismuto (Bi) es un metal. El nitrógeno existe como gas diatómico (N2), forma numerosos óxidos, tiene tendencia a aceptar tres electrones y formar el ion nitruro N 3-
El fósforo existe como como moléculas de P4, forma dos óxidos sólidos de fórmulas P4O6 y P4O10. El arsénico, antimonio y bismuto tienen estructuras tridimensionales. El bismuto es con mucho un metal mucho menos reactivo que los de los grupos anteriores.
1. Nitrógeno:
Elemento químico, símbolo N, número atómico 7, peso atómico 14.0067; es un gas en condiciones normales. El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.

Características:
A altas temperaturas, reacciona con cromo, silicio, titanio, aluminio, boro, berilio, magnesio, bario, estroncio, calcio y litio para formar nitruros; con O2, para formar NO, y en presencia de un catalizador, con hidrógeno a temperaturas y presión bastante altas, para formar amoniaco.
Obtención:
El nitrógeno se obtiene a gran escala por destilación fraccionada de aire líquido. En el laboratorio se obtiene N2 de alta pureza por descomposición térmica de NaN3.
Aplicaciones:
La mayor parte del nitrógeno se utiliza en la formación de amoniaco. Ademas, el nitrógeno liquido se utiliza extensamente en criogenia para alcanzar bajas temperaturas y como gas para crear atmósferas inertes. Obtención de fertilizantes. Se usa en pequeñas cantidades en lamparas, es componente básico del ácido nítrico, amoniaco, cianamidos, tintes, compuestos de colado o de plásticos derivados de la urea. Cianuros y nitruros para cubiertas endurecedoras de metales y numerosos compuestos orgánicos sintéticos y otros nitrogenados.

Propiedades:
Número atómico 7
Valencia 1,2,+3,-3,4,5
Estado de oxidación -3
Electronegatividad 3,0
Radio covalente (Å) 0,75
Radio iónico (Å) 1,71
Radio atómico (Å) 0,92
Configuración electrónica 1s22s22p3
Primer potencial de ionización (eV) 14,66
Masa atómica (g/mol) 14,0067
Densidad (g/ml) 0,81
Punto de ebullición (ºC) -195,79 ºC
Punto de fusión (ºC) -218,8
Descubridor Rutherford en 1772
2. Fósforo:
Existen 3 formas alotrópicas más importantes que son: blanco, negro y rojo.
Fósforo blanco:
Es muy venenoso, insoluble en agua pero soluble en benceno y sulfuro de carbono. Es una sustancia muy reactiva, su inestabilidad tiene su origen en el ángulo de 60º de las unidades P4. Es la más reactiva de todas las formas alotrópicas.

Fósforo negro:
Es cinéticamente inerte y no arde al aire incluso a 400°C.

Fósforo rojo:
No es venenoso, insoluble en todos los disolventes y arde al aire por encima de los 400°C. Reacciona con los halógenos con menor violencia. Tiene una estructura polimérica con tetraedros P4 unidos entre sí.

Fósforo negro: Resulta de calentar el fósforo blanco a altas presiones.
Fósforo rojo: Se obtiene calentando el blanco en atmósfera inerte a 250°C.
Aplicaciones:
El fósforo blanco se utiliza como incendiario, pero los compuestos de fósforo más empleados son el ácido fosfórico y los fosfatos.
Acero: desoxidante; aumenta la resistencia y la resistencia a la corrosión ayudan a que las laminas de acero no se peguen entre sí.
Bronce: Desoxidante; incrementa la dureza.
Cobre: Desoxidante , incrementa la dureza y la resistencia; reduce la conductividad eléctrica.
Latón: Desoxidante
Pigmentos colorantes: Azules, verdes.
Vidrio: vidrio especial resistente al ácido fluorhídrico; opacador.
Textiles: Mordente.
El fósforo no se encuentra libre en la naturaleza. Sin embargo, sus compuestos abundan y están distribuidos ampliamente; se encuentran en muchos yacimientos de roca y minerales.
El fósforo es uno de los elementos esenciales para el crecimiento y desarrollo de las plantas.
Propiedades:
Número atómico 15
Valencia +3,-3,5,4
Estado de oxidación +5
Electronegatividad 2,1
Radio covalente (Å) 1,06
Radio iónico (Å) 0,34
Radio atómico (Å) 1,28
Configuración electrónica [Ne]3s23p3
Primer potencial de ionización (eV) 11,00
Masa atómica (g/mol) 30,9738
Densidad (g/ml) 1,82
Punto de ebullición (ºC) 280
Punto de fusión (ºC) 44,2
Descubridor Hennig Brandt en 1669
3. Arsénico:
El arsénico es un metal de color gris de plata, extremadamente frágil y cristalizado que se vuelve negro al estar expuesto al aire. Es inadecuado para el uso común de los metales dada su toxicidad (extremadamente venenoso). es considerado como un elemento perjudicial en las aleaciones, ya que tiende a bajar el punto de fusión y a causar fragilidad.

Aplicaciones:

Propiedades:
Número atómico 33
Valencia +3,-3,5
Estado de oxidación +5
Electronegatividad 2,1
Radio covalente (Å) 1,19
Radio iónico (Å) 0,47
Radio atómico (Å) 1,39
Configuración electrónica [Ar]3d104s24p3
Primer potencial de ionización (eV) 10,08
Masa atómica (g/mol) 74,922
Densidad (g/ml) 5,72
Punto de ebullición (ºC) 613
Punto de fusión (ºC) 817
Descubridor Antigüedad
4. Antimonio:
El antimonio tiene una conductividad eléctrica menos en estado sólido que en estado líquido lo cual lo hace diferente a los metales normales, en forma metálica es muy quebradizo, de color blanco-azuloso con un brillo metálico característico, de apariencia escamosa.
Aplicaciones:
El antimonio se obtiene calentando el sulfuro con hierro, o calentando el sulfuro y el sublimado Sb4O6 obtenido se reduce con carbono. El antimonio de alta pureza se produce por refinado electrolítico.

Propiedades:
Número atómico 51
Valencia +3,-3,5
Estado de oxidación +5
Electronegatividad 1,9
Radio covalente (Å) 1,38
Radio iónico (Å) 0,62
Radio atómico (Å) 1,59
Configuración electrónica [Kr]4d105s25p3
Primer potencial de ionización (eV) 8,68
Masa atómica (g/mol) 121,65
Densidad (g/ml) 6,62
Punto de ebullición (ºC) 1380
Punto de fusión (ºC) 630,5
Descubridor Antigüedad
5. Bismuto:
Es un metal pesado (es el elemento más metálico de este grupo), de color blanco grisáceo y cristalizado que tiene brillo muy apreciable. Es una de los pocos metales que se dilatan en su solidificación, también es el más diamagnético de todos los metales y su conductividad térmica es menor que la de otros metales (excepto la del mercurio). Se oxida ligeramente cuando esta húmedo y es inerte al aire seco a temperatura ambiente, cuando supera su punto de fusión se forma rápidamente una película de óxido.

Aplicaciones:
Se encuentra naturalmente como metal libre y en minerales, sus principales depósitos se encuentran en suramerica, aunque en norteamerica se obtiene como subproducto del refinado de minerales de plomo y cobre.

Propiedades:
Número atómico 83
Valencia 3,5
Estado de oxidación +3
Electronegatividad 1,9
Radio covalente (Å) 1,46
Radio iónico (Å) 1,20
Radio atómico (Å) 1,70
Configuración electrónica [Xe]4f145d106s26p3
Primer potencial de ionización (eV) 8,07
Masa atómica (g/mol) 208,980
Densidad (g/ml) 9,8
Punto de ebullición (ºC) 1560
Punto de fusión (ºC) 271,3
Descubridor Antigüedad
Grupo 6 A de la tabla periódica:
El grupo 16 de la tabla periódica es también llamado como anfígenos, calcógenos o la familia del oxígeno. El término anfígeno procede del griego y significa formador de ácidos y bases. Por su parte, el término calcógeno proviene del griego y significa formador de minerales.
El oxígeno se halla en la naturaleza siendo el elemento más abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el aire y combinado con hidrógeno para producir agua. También se encuentra formando óxidos, hidróxidos y algunas sales. Por su parte, el azufre también se muestra en cantidad en estado elemental y combinado formando compuestos. El selenio y el telurio se hallan libres y combinados, no obstante con menos abundancia que los elementos anteriores. En último lugar, tenemos al polonio, el cual es un elemento radiactivo que se halla difícilmente en la naturaleza, generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
Propiedades físicas:
El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Otro alótropo importante es el trioxígeno (O3) o como normalmente se le conoce, el ozono. El ozono es un gas de olor picante y habitualmente incoloro, pero en altas concentraciones puede tornarse levemente azulado.
El azufre es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre, que son cadenas Sn (n = 3-10), S2.
El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
Y finalmente el polonio, el cual es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.
Propiedades químicas:
No reaccionan con el agua. No reaccionan con las bases a excepción del azufre. Reaccionan con el ácido nítrico concentrado, excepto el oxígeno. Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve reducida desde el oxígeno al teluro. Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo. Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo. Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
1. Oxígeno:
Es uno de los elementos más importantes y por tal razón posee una gran cantidad de aplicaciones. Principalmente, es utilizado en medicina como terapia para las personas que tienen dificultad para respirar debido a alguna enfermedad como enfisema o neumonía. El oxígeno gaseoso es venenoso para las bacterias anaeróbicas que producen gangrena (muerte de tejidos orgánicos), por lo que se emplea para eliminarlos. El envenenamiento por monóxido de carbono se trata también con oxígeno gaseoso.
El oxígeno con un alto grado de pureza se emplea en los trajes espaciales para que los astronautas puedan respirar.
Aplicaciones:
El oxígeno líquido es usado como comburente para el lanzamiento de cohetes espaciales, generalmente empleando RP-1 como combustible, en una mezcla llamada Kerolox.
2. Azufre:
Es un elemento químico fundamental y un componente principal de los aminoácidos cisteina y metionina y, por lo tanto, indispensable para la síntesis de proteínas presentes en todos los organismos vivos. Por tal razón, muchos agricultores que cultivan alimentos orgánicos emplean azufre como un pesticida y fungicida natural.
Pero la aplicación más destacada en el ámbito comercial de este elemento es en la obtención de ácido sulfúrico. El ácido sulfúrico es sumamente necesario para una gran cantidad de industrias. Este compuesto se emplea en la elaboración de fertilizantes, tratamiento de aguas residuales, baterías de plomo para vehículos, extracción de mineral, eliminación de óxido de hierro, producción de nylon y obtención de ácido clorhídrico.
Aplicaciones:
El sulfato de magnesio se emplea como laxante, en sales de baño y como un complemento de magnesio para las plantas. El disulfuro de carbono se usa para elaborar celofán y rayón. Los sulfitos se emplean para blanquear el papel y conservar la fruta.
3. Selenio:
El selenio gris conduce la electricidad, sin embargo su conductividad varía con la intensidad luminosa, es decir, es buen conductor en la luz que en la oscuridad. Por tal razón, se emplea en dispositivos fotoeléctricos, como las células solares, cámaras de rayos x, fotocopiadoras, medidores de luz, diodos LED de color azul y blanco, entre otros.
Por su parte, el selenio rojo o como seleniuro de sodio se emplea para proporcionar un color rojo carmesí al vidrio, barnices y esmaltes. También se puede usar para eliminar las tintas de color verde o amarillo ocasionados por otras impurezas durante el proceso de elaboración de vidrio.
Aplicaciones:
El compuesto sulfuro de selenio es un componente habitual en el champú anti-caspa que elimina el hongo que origina la descamación del cuero cabelludo. Así mismo se puede destinar para tratar algunos problemas de la piel producidos por otros hongos.
4. Telurio:
El telurio aleado con otros elementos es utilizado en la fabricación de discos compactos regrabables. La capa del CD-RW que contiene la información está constituida por una aleación cristalina de plata, indio, antimonio y telurio.
Fue descubierto en 1782 en minerales de oro por Franz-Joseph Müller von Reichenstein, inspector jefe de minas en Transilvania (Rumanía), denominándolo metallum problematicum. En principio se confundió el telurio con el antimonio. Fue Martin Heinrich Klaproth, en 1798, quien examinó el «metal problemático» de Müller y lo llamó telurio.
El telurio es un elemento relativamente estable, insoluble en agua y ácido clorhídrico, pero soluble en ácido nítrico y en agua regia. Reacciona con un exceso de cloro para formar dicloruro de teluro, TeCl2 y tetracloruro de teluro, TeCl4. Se oxida con ácido nítrico y produce dióxido de teluro, TeO2, y con ácido crómico para dar ácido telúrico, H2TeO4. En combinación con el hidrógeno y ciertos metales, forma telururos, como el telururo de hidrógeno, H2Te, y el telururo de sodio, Na2Te. El teluro tiene un punto de fusión de 452° C, un punto de ebullición de 990° C, y una densidad relativa de 6,25. Su masa atómica es 127,60.

Aplicaciones:
Los compuestos de telurio se usan ampliamente en la química orgánica sintética para la reducción y oxidación, ciclofuncionalización, deshalogenación, reacciones de generación de carbaniones y eliminación de grupos protectores. Los compuestos organometálicos son intermedios en la síntesis de aminas, dioles y productos naturales. El telurio es un componente de importancia clave en los catalizadores de óxidos mixtos de alto rendimiento para la oxidación selectiva catalítica heterogénea de propano a ácido acrílico. En presencia de vapor de agua, la superficie del catalizador se enriquece en telurio y vanadio lo que se traduce en la mejora de la producción de ácido acrílico. El telurio puede usarse en sensores de amoníaco y cristales de telurita.
Isotopos:
Se conocen 29 isótopos del telurio, con masas atómicas que fluctúan entre 108 y 137. En la naturaleza hay 8 isótopos del telurio, de los cuales tres son radiactivos. El 128Te tiene el periodo de semidesintegración más largo conocido de todos los radioisótopos de telurio (2,2·1024 años). El telurio es el elemento con menor número atómico que puede experimentar la desintegración alfa. Con los isótopos del 106Te al 110Te, puede experimentar este tipo de desintegración.
5. Polonio:
El polonio es un elemento químico en la tabla periódica de los elementos cuyo símbolo es Po y su número atómico es 84. Se trata de un raro metal altamente radiactivo, químicamente similar al telurio y al bismuto, presente en minerales de uranio.

Características:
Esta sustancia se disuelve con mucha facilidad en ácidos, pero es sólo ligeramente soluble en alcalinos. Está químicamente relacionado con el teluro y el bismuto. El polonio es un metal volátil, reducible al 50% tras 45 horas al aire a una temperatura de 54,8 °C (328 K). Ninguno de los 50 isotopos [numero estimado] de polonio es estable. Es extremadamente tóxico y altamente radiactivo. Se ha encontrado polonio en minerales de uranio, humo de tabaco y como contaminante. Todos los elementos a partir del polonio son significativamente radiactivos. Se encuentra en el grupo 16 y su número atómico es 84.

Aplicaciones:
Se utiliza también en dispositivos destinados a la eliminación de carga estática, en cepillos especiales para eliminar el polvo acumulado en películas fotográficas y también en fuentes de calor para satélites artificiales o sondas espaciales.
Efectos negativos:
Estos son los siguientes síntomas:
Los efectos por exposición son fallos orgánicos, caída del cabello, dolores gástricos, daños de pulmón y riñones y fallo total del sistema inmune. Si la intoxicación es baja los síntomas se atenúan hasta desaparecer en unos días. El tratamiento medico pasa por un quelante o compuesto químico que ayuda a expulsar el polonio 210 a través de las heces y la orina.

Obtención:
En 1934 se demostró que, cuando el bismuto natural (209Bi) es bombardeado con neutrones, se crea 210Bi, que se transforma mediante una desintegración beta en Polonio-210. Se puede crear polonio en cantidades de miligramos mediante este procedimiento, utilizando flujos de neutrones grandes, como los que se encuentran en los reactores nucleares.
Precauciones:
El polonio es un elemento altamente tóxico (DL50 = 10ng (inhalados) o 50 ng (ingeridos) en seres humanos), radiactivo y de peligroso manejo. Incluso en cantidades de microgramos, el manejo de 210Po, es muy peligroso y requiere de equipamiento especial utilizado bajo estrictos procedimientos de seguridad.
6. Livermorio:
Su nombre viene dado en honor al Laboratorio Nacional Lawrence Livermore (Lawrence Livermore National Laboratory), en Livermore, California.
En 1999, investigadores del Laboratorio Nacional Lawrence Berkeley anunciaron la creación del elemento 116, en un artículo publicado en una revista de los EEUU llamada Physical Review Letters, explican que lo hicieron cuando se observó el decaimiento-α de un átomo de mayor número atómico. El año siguiente publicaron su retracción tras ver que no eran capaces de volver a hacer el experimento.3 En junio de 2002, el director del laboratorio anunció que los datos del experimento habían sido falseados por su autor principal Victor Ninov.
En junio de 2000, el Instituto Conjunto para la Investigación Nuclear, en la ciudad de Dubna, realizó estudios por los cuales se describió el decaimiento-α del isótopo 292Uuh que se produjo en la reacción de fusión de un núcleo de 248 Cm al ser bombardeado con iones de 48 Ca acelerados por un ciclotrón, como producto secundario se obtuvieron 4 neutrones. Tiene una vida media de cerca de 6 milisegundos (0,006 segundos). Luego de esto tiene un decaimiento-α en 288Fl (Flerovio) seguido de dos más consecutivos en otros átomos de menor número atómico para más tarde tener una fisión espontánea.
Nuevos experimentos se hicieron entre finales de 2000 e inicios de 2001, pero estos fallaron en crear un nuevo átomo.

Aplicaciones:
Por su inestabilidad, vida media tan reducida y dificultad de obtención, en la actualidad son nulas las aplicaciones industriales, comerciales o propagandísticas de este elemento muy pesado por lo que su aplicación se relega sólo a la investigación científica.
Grupo 7 A de la tabla periódica:
1. Flúor:
Sus derivados tienen mucho uso industrial. Entre ellos se destaca el freón utilizado como congelante y la resina teflón. Se agregan además fluoruros al agua potable y detríficos para prevenir las caries. Símbolo F, número atómico 9, miembro de la familia de los halógenos con el número y peso atómicos más bajos. Aunque sólo el isótopo con peso atómico 19 es estable, se han preparado de manera artificial los isótopos radiactivos, con pesos atómicos 17 y 22, el flúor es el elemento más electronegativo, y por un margen importante, el elemento no metálico más energético químicamente.
Propiedades:
Número atómico 9
Valencia -1
Estado de oxidación -1
Electronegatividad 4,0
Radio covalente (Å) 0,72
Radio iónico (Å) 1,36
Radio atómico (Å) -
Configuración electrónica 1s22s22p5
Primer potencial de ionización (eV) 17,54
Masa atómica (g/mol) 18,9984
Densidad (g/ml) 1,11
Punto de ebullición (ºC) -188,2
Punto de fusión (ºC) -219,6
Descubridor Moissan en 1886
Aplicaciones:
El flúor reacciona con violencia considerable con la mayor parte de los compuestos que contienen hidrógeno, como el agua, el amoniaco y todas las sustancias orgánicas, sean líquidos, sólidos o gases. La reacción del flúor con el agua es compleja y produce principalmente fluoruro de hidrógeno y oxígeno, así como cantidades menores de peróxido de hidrógeno, difluoruro de oxígeno y ozono. El flúor desplaza otros elementos no metálicos de sus compuestos, aun aquellos muy cercanos en cuanto a actividad química. Desplaza el cloro del cloruro de sodio y el oxígeno en la sílica, en vidrio y en algunos materiales cerámicos. En ausencia de fluoruro de hidrógeno, el flúor no ataca en forma significativa al cuarzo o al vidrio, ni aun después de varias horas a temperaturas hasta de 200ºC (390ºF).

Precauciones:
El flúor es un elemento muy tóxico y reactivo. Muchos de sus compuestos, en especial los inorgánicos, son también tóxicos y pueden causar quemaduras severas y profundas. Hay que tener cuidado para prevenir que líquidos o vapores entren en contacto con la piel y los ojos.

Frecuencia natural:
Compuestos:
En todos los compuestos de flúor la alta electronegatividad de este compuesto indica que el átomo de flúor tiene un exceso de carga negativa. Es conveniente, sin embargo, dividir los fluoruros binarios inorgánicos en sales (red iónica), fluoruros metálicos no volátiles y fluoruros volátiles, la mayor parte de no metales. Algunos hexafluoruros metálicos y los fluoruros de gases nobles muestran volatilidad que son frecuencia está asociada a un compuesto molecular. La volatilidad se asocia a menudo con números de oxidación altos para el elemento positivo.
2. Cloro:
Sus propiedades blanqueadoras lo hacen muy útil en las papeleras e industrias textiles. Como desinfectante se agrega al agua en el proceso de potabilización y a las piscinas.Otros usos son las industrias de colorantes y la elaboración de ciertas medicinas.

Propiedades:
Valencia +1,-1,3,5,7
Estado de oxidación -1
Electronegatividad 3.0
Radio covalente (Å) 0,99
Radio iónico (Å) 1,81
Radio atómico (Å) -
Configuración electrónica [Ne]3s23p5
Primer potencial de ionización (eV) 13,01
Masa atómica (g/mol) 35,453
Densidad (g/ml) 1,56
Punto de ebullición (ºC) -34,7
Punto de fusión (ºC) -101,0
Descubridor Carl Wilhelm Scheele en 1774
Precauciones:
La exposición al cloro puede ocurrir en el lugar de trabajo o en el medio ambiente a causa de escapes en el aire, el agua o el suelo. Las personas que utilizan lejía en la colada y productos químicos que contienen cloro no suelen estar expuestas a cloro en sí. Generalmente el cloro se encuentra solamente en instalaciones industriales.
El cloro entra en el cuerpo al ser respirado el aire contaminado o al ser consumido con comida o agua contaminadas. No permanece en el cuerpo, debido a su reactividad.
Los efectos del cloro en la salud humana dependen de la cantidad de cloro presente, y del tiempo y la frecuencia de exposición. Los efectos también dependen de la salud de la persona y de las condiciones del medio cuando la exposición tuvo lugar.
El cloro entra en el cuerpo al ser respirado el aire contaminado o al ser consumido con comida o agua contaminadas. No permanece en el cuerpo, debido a su reactividad.
Los efectos del cloro en la salud humana dependen de la cantidad de cloro presente, y del tiempo y la frecuencia de exposición. Los efectos también dependen de la salud de la persona y de las condiciones del medio cuando la exposición tuvo lugar.
La respiración de pequeñas cantidades de cloro durante cortos periodos de tiempo afecta negativamente al sistema respiratorio humano. Los efectos van desde tos y dolor pectoral hasta retención de agua en los pulmones. El cloro irrita la piel , los ojos y el sistema respiratorio. No es probable que estos efectos tengan lugar a niveles de cloro encontrados normalmente en la naturaleza.
Los efectos en la salud humana asociados con la respiración o el consumo de pequeñas cantidades de cloro durante periodos prolongados de tiempo no son conocidos. Algunos estudios muestran que los trabajadores desarrollan efectos adversos al estar expuestos a inhalaciones repetidas de cloro, pero otros no.
3. Bromo:
Elemento químico, Br, número atómico 35 y peso atómico 79.909, por lo común existe como Br2; líquido de olor intenso e irritante, rojo oscuro y de bajo punto de ebullición, pero de alta densidad. Es el único elemento no metálico líquido a temperatura y presión normales. Es muy reactivo químicamente; elemento del grupo de los halógenos, sus propiedades son intermedias entre las del cloro y las del yodo.

Propiedades:
Valencia +1,-1,3,5,7
Estado de oxidación -1
Electronegatividad 2,8
Radio covalente (Å) 1,14
Radio iónico (Å) 1,95
Radio atómico (Å) -
Configuración electrónica [Ar]3d104s24p5
Primer potencial
de ionización (eV) 11,91
Masa atómica (g/mol) 79,909
Densidad (g/ml) 3,12
Punto de ebullición (ºC) 58
Punto de fusión (ºC) -7,2
Descubridor Anthoine Balard en 1826
Aplicaciones:
Muchos bromuros inorgánicos tienen uso industrial, pero los orgánicos tienen una aplicación más amplia. Gracias a la facilidad de reacción con compuestos orgánicos, y a la fácil eliminación o desplazamiento posterior, los bromuros orgánicos se han estudiado y utilizado como intermediarios químicos. Además, las reacciones del bromo son tan limpias que pueden emplearse en el estudio de mecanismos de reacción sin la complicación de reacciones laterales. La capacidad del bromo para unirse a posiciones poco usuales de las moléculas orgánicas tiene un valor adicional como herramienta de investigación.
El bromo y sus compuestos se usan como agentes desinfectantes en albercas y agua potable. Algunos de sus compuestos son más seguros que los análogos de cloro, por la persistencia residual de los últimos. Otros compuestos químicos del bromo se utilizan como fluidos de trabajo en medidores, fluidos hidráulicos, intermediarios en la fabricación de colorantes, en acumuladores, en supresores de explosión y sistemas de extinción de fuego. La densidad de los compuestos de bromo también los hace útiles en la separación gradual del carbón y otros minerales por gradientes de densidad. La gran aplicabilidad de los compuestos de bromo se comprueba en el uso comercial de cerca de 100 compuestos de bromo.

Precauciones - Efectos:
El bromo es un elemento que se da en la naturaleza y que puede encontrarse en muchas sustancias inorgánicas. Los humanos, sin embargo, empezaron hace muchos años a introducir bromuros orgánicos en el medio ambiente. Estos son todos ellos compuestos que no son naturales y pueden causar graves daños a la salud humana y el medio ambiente.
Los humanos podemos absorber bromuros orgánicos a través de la piel, con la comida y durante la respiración. Los bromuros orgánicos son ampliamente usados como sprays para matar insectos y otras plagas no deseadas. Pero no solo son venenosas para los animales contra los que son usados, sino también para los animales más grandes. En muchos casos también son venenosos para los humanos.
Los efectos sobre la salud más importantes que pueden ser causados por contaminantes orgánicos que contienen bromuros son disfunciones del sistema nervioso y alteraciones del material genético. Pero los bromuros orgánicos pueden también dañar ciertos órganos como el hígado, riñones, pulmones y testículos y puede causar disfunciones estomacales y gastrointestinales. En la naturaleza se encuentran algunas formas de bromuros inorgánicos, pero a pesar de que se dan naturalmente, los humanos han añadido demasiado a lo largo de los años. A través de la comida y del agua los humanos absorbemos altas dosis de bromuros inorgánicos. Estos bromuros pueden perjudicar al sistema nervioso y la glándula tiroides.

4.Yodo:
Elemento no metálico, símbolo I, número atómico 53, masa atómica relativa 126.904, el más pesado de los halógenos (halogenuros) que se encuentran en la naturaleza. En condiciones normales, el yodo es un sólido negro, lustroso, y volátil; recibe su nombre por su vapor de color violeta.
La química del yodo, como la de los otros halogenos, se ve dominada por la facilidad con la que el átomo adquiere un electrón para formar el ion yoduro, I-, o un solo enlace covalente –I, y por la formación, con elementos más electronegativos, de compuestos en que el estado de oxidación formal del yodo es +1, +3, +5 o +7. El yodo es más electropositivo que los otros halógenos y sus propiedades se modulan por: la debilidad relativa de los enlaces covalentes entre el yodo y elementos más electropositivos; los tamaños grandes del átomo de yodo y del ion yoduro, lo cual reduce las entalpías de la red cristalina y de disolución de los yoduros , en tanto que incrementa la importancia de las fuerzas de van der Waals en los compuestos del yodo, y la relativa facilidad con que se oxida éste.
Aplicaciones:
Las propiedades bactericidas del yodo apoyan sus usos principales para el tratamiento de heridas o la esterilización del agua potable. Asimismo los compuestos de yodo se utilizan para tratar ciertas condiciones de la tiroides y del corazón, como suplemento dietético (en la forma de sales yodatadas) y en los medios de contraste para los rayos X.
Los usos industriales principales se encuentran en la fotografía, en donde el yoduro de plata es uno de los constituyentes de las emulsiones para películas fotográficas rápidas, y en la industria de los tintes, en donde los tintes a base de yodo se producen para el procesamiento de alimentos y para la fotografía en colores.

Precauciones - Efectos:
El yodo se añade a casi cualquier sal. Es un ingrediente del pan, los peces marinos y las plantas oceánicas. El yodo está presente de forma natural en los océanos y algunos peces marinos y plantas acuáticas lo almacenan en sus tejidos.
Muchas medicinas y limpiadores para heridas de la piel contienen yodo. También es un ingrediente de las tabletas purificadoras de agua que se usan para preparar agua potable.
El yodo es un material de construcción de las hormonas tiroideas que son esenciales para el crecimiento, el sistema nervioso y el metabolismo. Las personas que comen muy poco o nada de pan pueden experimentar carencia de yodo. Entonces la función de la glándula tiroides disminuirá y la glándula tiroides empezará a hincharse. Este fenómeno se llama estruma. Ahora esta afección es rara, ya que la sal de mesa lleva una pequeña dosis de yodo. Grandes cantidades de yodo pueden ser peligrosas porque la glándula tiroides trabajaría demasiado. Esto afecta al cuerpo entero; provoca taquicardias y pérdida de peso. El yodo elemental, I2, es tóxico, y su vapor irrita los ojos y los pulmones. La concentración máxima permitida en aire cuando se trabaja con yodo es de solamente 1 mg/m3. Todos los yoduros son tóxicos tomados en exceso.

CONCLUSIONES:
En general, la tabla periódica tiene mucha variedad de elementos, en cada uno de ellos podemos observar e indagar diferentes aspectos de cada uno, como sus aplicaciones, su complementación, las precauciones y efectos, toda la información de mucha importancia para comprender muy bien la tabla periódica.
WEB-GRAFÍA:
Realización del marco teórico:
Grupo 4A de la tabla periódica, elementos:
Grupo 5A de la tabla periódica, elementos:
Grupo 6A de la tabla periódica, elementos:
- http://www.quimicaencasa.com/grupo-16-la-tabla-periodica-familia-del-oxigeno/
- https://es.wikipedia.org/wiki/Telurio
- https://es.wikipedia.org/wiki/Polonio
- https://es.wikipedia.org/wiki/Livermorio
Grupo 7A de la tabla periódica:
GRUPOS BUEN TRABAJO 4,5
ResponderEliminarJUEGO NO VEO EL LINK 2,0
DEFINITIVA 3,2
PARA LA NIVELACIÓN SE VALE LOS PANTALLAZOS PERO YA DEBE TENER EL LINK 4,0
ResponderEliminarDEFINITIVA NIVELACIÓN 4,2