Hidrocarburos Aromáticos
Laura Karina Castañeda Vanegas
11-1
Química
Profesora: Diana Jaramillo
Institución Educativa Exalumnas de la
Presentación
Ibagué - Tolima
2019
INTRODUCCIÓN:
OBJETIVOS:
Objetivo General:
Objetivos Específicos:
MARCO TEÓRICO:























En el siguiente trabajo se hablará todo sobre los Hidrocarburos Aromáticos con el fin de repasar y recordar cualquier tema visto. Además se podrá aprender todo sobre ellos, su historia, sus fórmulas, ejemplos, aplicaciones y todo lo que nos pueda ayudar para nuestra vida cotidiana.
OBJETIVOS:
Objetivo General:
Aprender de manera general toda la información suministrada sobre el tema visto, analizando y comprendiendo su fin y aplicación.
Objetivos Específicos:
Aprender algunas cosas sobre los Aromáticos que aún no sabemos.
Comprender la aplicación de cada uno de los sustituyentes utilizados en el trabajo.
Entender para qué sirve la investigación de los Hidrocarburos Aromáticos.
Poner en práctica todo lo aprendido.
MARCO TEÓRICO:
En este trabajo se hablará sobre los Hidrocarburos Aromáticos. Para hablar de ellos, principalmente tenemos que hablar del benceno.
- Estructura de la molécula del benceno:
Su análisis determinó que tiene una fórmula molecular de C6H6 y una fórmula estructural:
Se han propuesto muchas fórmulas moleculares, pero la que apunta al concepto moderno de la molécula de Kekulé. Esta teoría permite la comprensión de las moléculas orgánicas y sus reacciones, y conduce a un auge de la investigación en la síntesis química de los compuestos orgánicos a partir de 1860.
Se han propuesto muchas fórmulas moleculares, pero la que apunta al concepto moderno de la molécula de Kekulé. Esta teoría permite la comprensión de las moléculas orgánicas y sus reacciones, y conduce a un auge de la investigación en la síntesis química de los compuestos orgánicos a partir de 1860.
- Nomenclatura:
-Compuestos monosustituyentes:
- Bromobenceno
- Clorobenceno
- Nitrobenceno
- Etilbenceno
- Nombres comunes:
- Tolueno

- Fenol

- Anilina o Aminobenceno

- Estireno o vinilbenceno
- Compuestos disustituyentes:
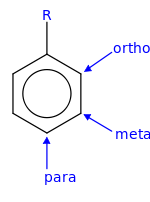

- En la sustitución orto, los dos sustituyentes ocupan posiciones próximas o contiguas entre sí, que se numeran como carbonos 1 y 2. En la figura, esas posiciones se han señalado con los símbolos R y orto.
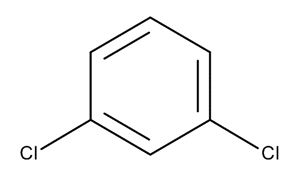
- En la sustitución meta, los dos sustituyentes ocupan las posiciones 1 y 3. En la figura, esas posiciones se han señalado con los símbolos R y meta.
- En la sustitución para, los dos sustituyentes ocupan las posiciones opuestas 1 y 4. En la figura, esas posiciones se han señalado con los símbolos R y para.
- O-dibromobenceno

- M-diclorobenceno

- P-dinitrobenceno
Cuando algunos de los grupos sustituyentes le da nombre común al anillo, se toma este como nombre principal y se le antepone el nombre del otro grupo sustituyente.
- P-cloroanilina

- M-yodofenol

- O-bromotolueno

Algunos derivados sustituyentes reciben nombres comunes.
- Catecol

- Resorcinol
- Hidroquinona

Si hay 3 o más grupos sustituyentes en el benceno, se utiliza el sistema de numeración tomando como posición 1 la del sustituyente que le da el nombre.
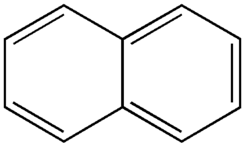
- Hidrocarburos aromáticos condensados o policíclicos:
- Naftaleno

- Antraceno

- Fenantreno

- Propiedades físicas:
En condiciones ambientales el benceno y sus derivados hasta de 12 átomos de carbono son líquidos y de ahí en adelante son sólidos. Por ser moléculas apolares o débilmente polares, son insolubles en agua y demás solventes polares, pero se disuelven en eter y tetracloruro de carbono (CCl4).
- Propiedades químicas:
1. Halogenación:
Algunos tipos de compuestos aromáticos, tales como fenol, van a reaccionar sin un catalizador, pero para los derivados del benceno típicos frente a sustratos menos reactivos, es necesario un ácido de Lewis como catalizador. Entre los ácidos Lewis que actúan como catalizadores habituales tenemos al AlCl3, FeCl3, FeBr3 y ZnCl2. Estos actúan formando un gran complejo electrofílico que ataca al anillo de benceno.

2. Nitración:
La nitración no puede efectuarse sólo con ácido nítrico. Se necesita "activar" el nítrico por medio del ácido sulfúrico, más fuerte que él.
Aunque el ácido nítrico es considerado como un ácido fuerte, la acidez es un término relativo y, frente a un ácido más fuerte que él, como el ácido sulfúrico, el HNO3 se comporta como base.
3. Alquilación:
En el caso más simple, implica la reacción entre un haluro de alquilo y una molécula de benceno en presencia de un ácido de Lewis como catalizador. Los productos son alquilbenceno y haluro de hidrógeno.

- Sutituciones derivadas del benceno:
- Orientadores orto - para:
- NH2 (Anilina)
- OH (Fenol)
- R (Alquil)
- X (Halógeno)
- Orientadores meta:
- CHO (Aldehído)
- COOH (Ácido)
- NO2 (Nitro)
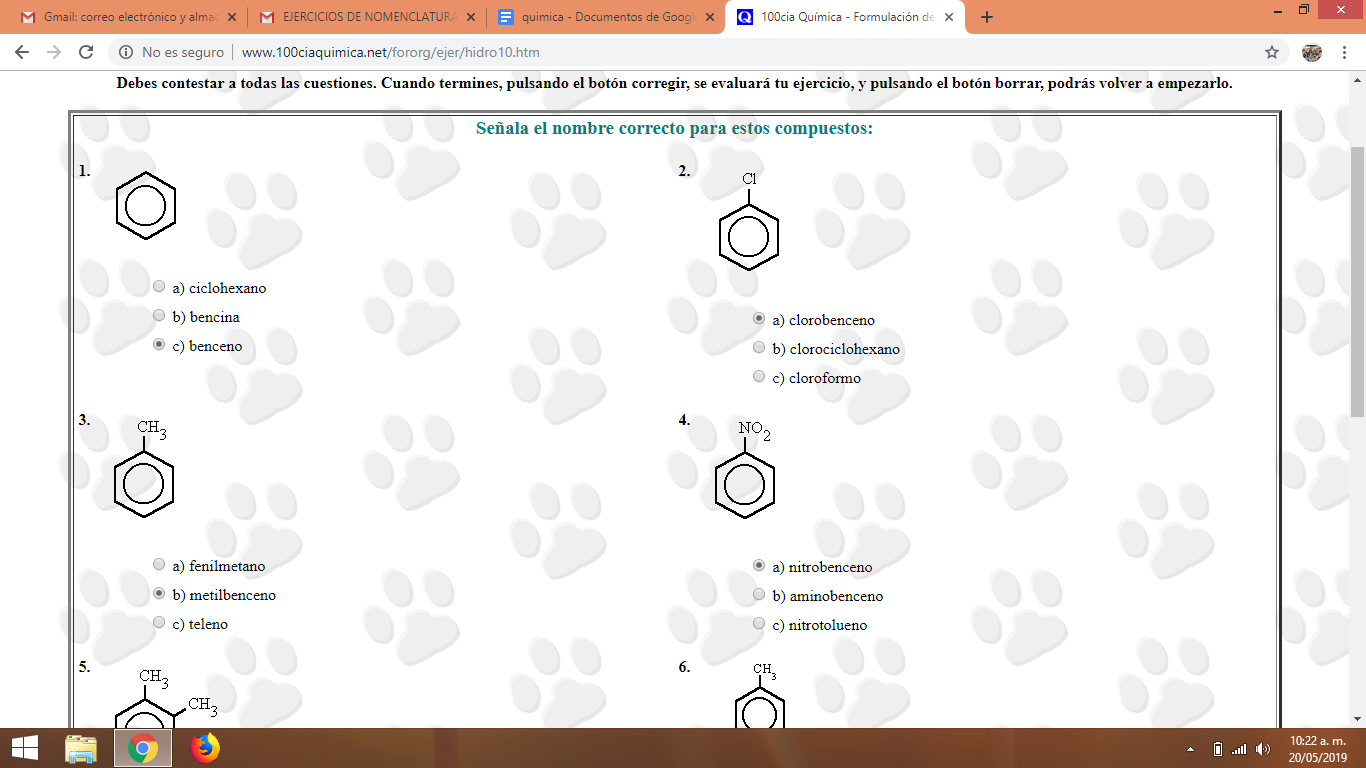
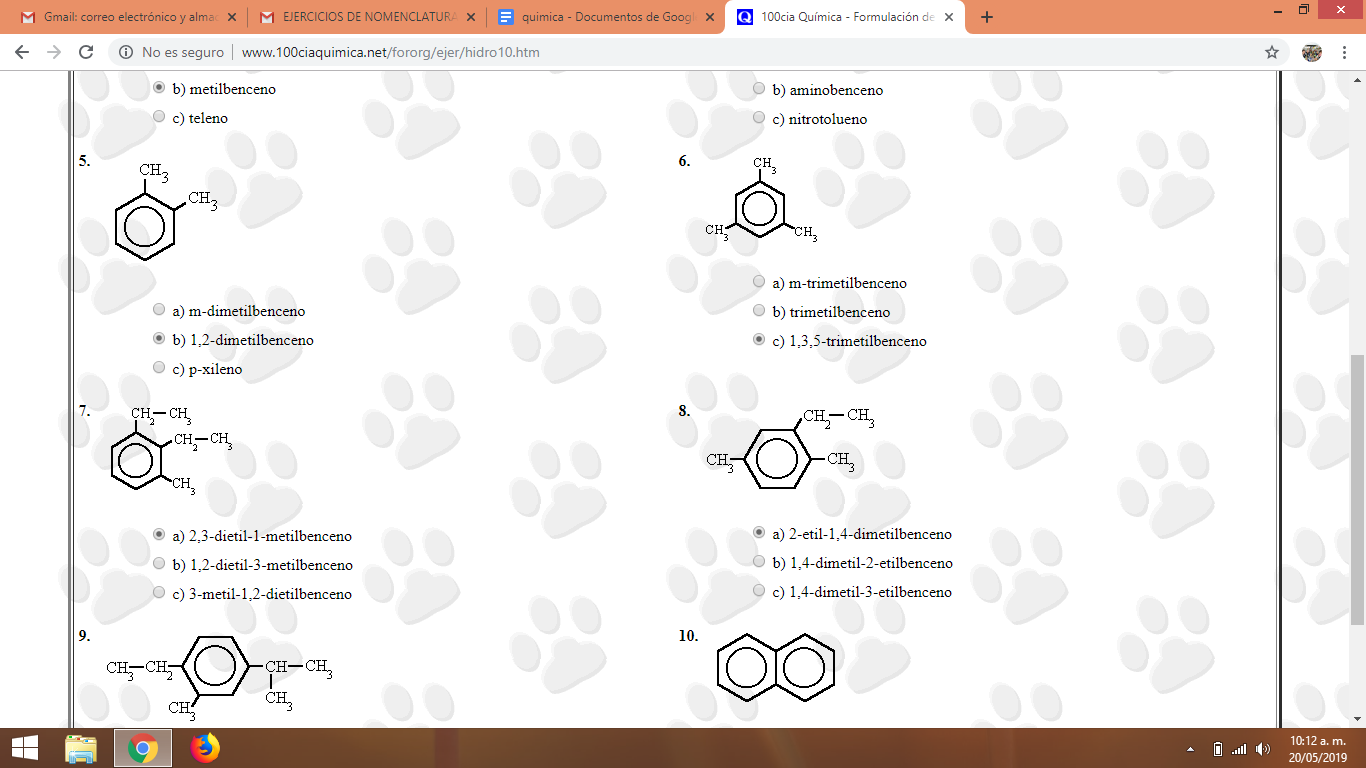
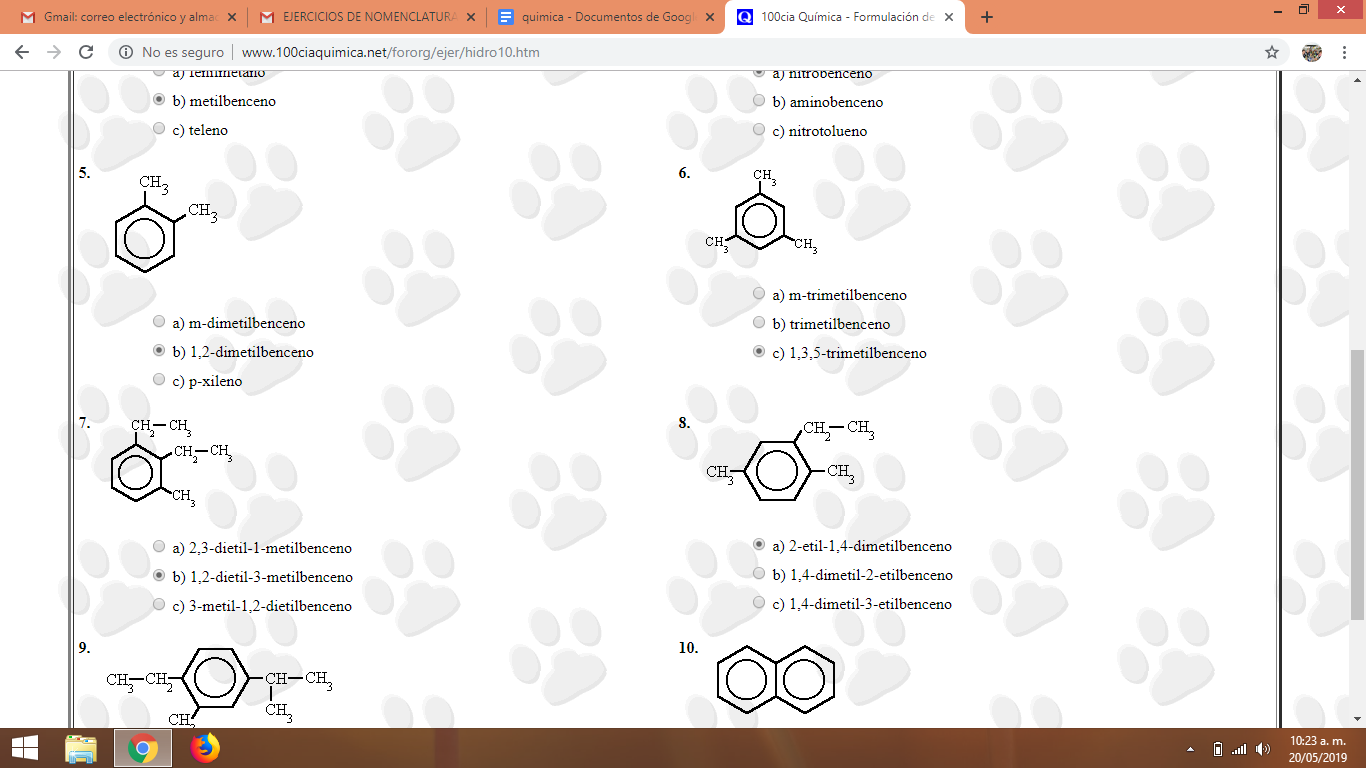
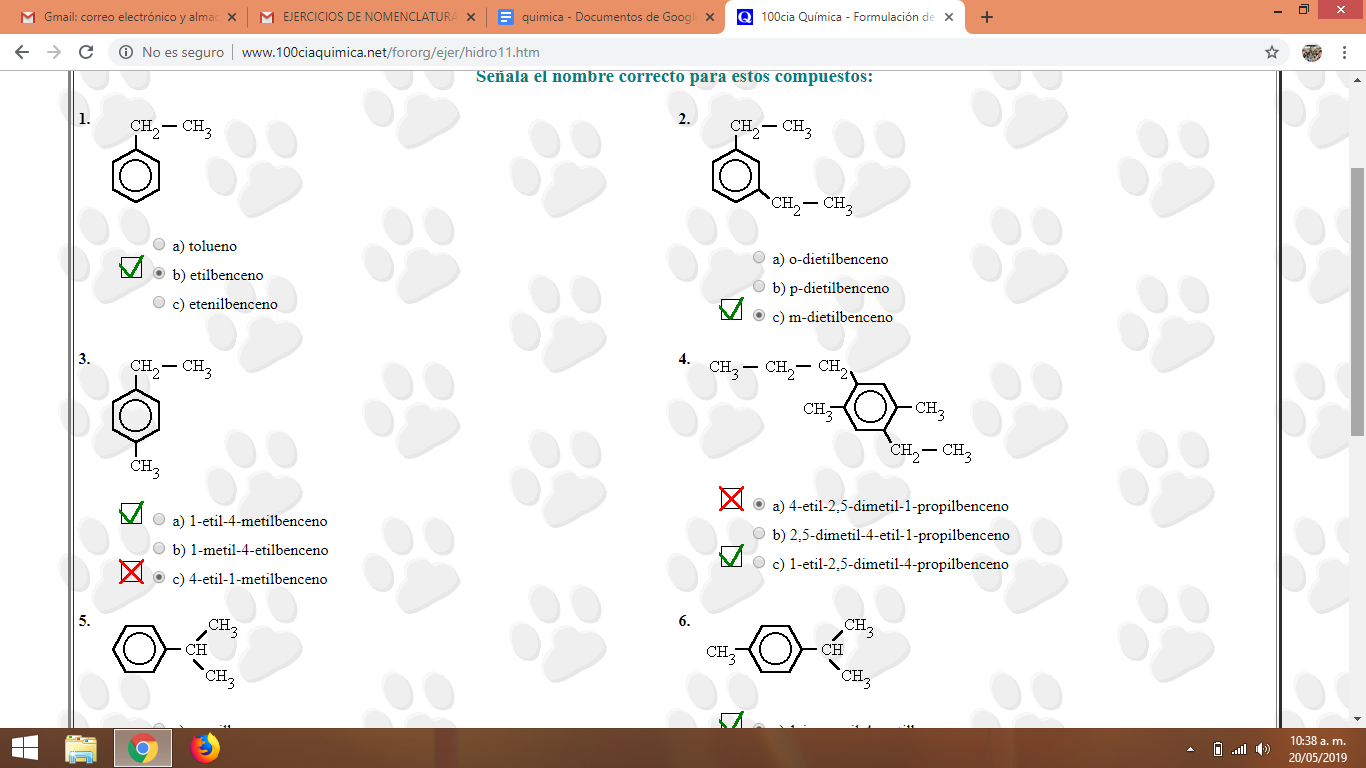
Pantallazos actividad realizada en clase
Hidrocarburos Aromáticos:
- 1 link:
- 2 link:




BUEN TRABAJO 4,5
ResponderEliminar